AG Dietrich "Identifikation pharmakologischer Zielstrukturen in pathophysiologischen Mechanismen"
Experimentelle Pharmakotherapie:
"Identifikation pharmakologischer Zielstrukturen in pathophysiologischen Mechanismen"
Leitung: Prof. Dr. rer. nat. Alexander Dietrich (english version)
Doktorandinnen und Doktoranden: Philipp Alt (Apotheker), Fabienne Geiger (M. Sc. in Biochemistry), Isabel Müller (M. Sc. in Chemistry), Suhasini Rajan (M. Sc. Translational Medical Research), Lena Schaller (M. Sc. in Medical Science)
Technische Assistentin: Bettina Braun (Biologielaborantin)
In der Abteilung Experimentelle Pharmakotherapie werden pharmakologische Zielstrukturen in pathophysiologischen Mechanismen identifiziert. Ziel ist es, einmal durch Applikation von Aktivatoren oder Blockern dieser Zielstrukturen therapeutisch, zuerst im Tierversuch und später auch im Patienten, eingreifen zu können. Als Modellsystem dient die Maus, in der durch molekularbiologische Methoden Gene zerstört werden (sog. gendefiziente oder „knock-out“ Mausmodelle), um die Auswirkungen des fehlenden Proteinprodukts auf die Physiologie und Pathophysiologie verschiedener Organsystem untersuchen zu können.
Neben Rezeptoren sind auch Ionenkanäle wichtige Angriffspunkte von Medikamenten. Aus diesem Grund untersuchen wir Funktionen der „transient receptor potential“ (TRP)-Kanäle (z.B. classical TRP 6 (TRPC6) (Abb. 1)) bei der Entstehung von Erkrankungen der Lunge (1) und anderer Organe.
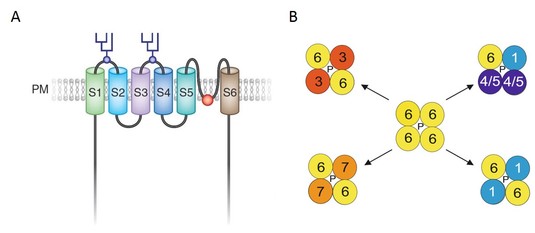
Abb. 1: (A) Aufbau des TRPC6 Kanals: Mit 6 Transmembrandomänen (S1 – S6) ist der Kanal in der Plasmamembran (PM) verankert. Er besitzt außerdem zwei extrazelluläre Glykosilierungsstellen zwischen den S1- und S2- und den S3- und S4-Segmenten. Zwischen den S5- und S6-Segmenten befindet sich eine konservierte Region zur Porenbildung (aus 2). (B) Ein funktioneller TRPC-Kanal besteht aus vier gleichen oder unterschiedlichen TRPC-Monomeren, die zusammen eine funktionelle Pore (P) bilden, durch die unselektiv Kationen wie Na+ und Ca2+ in die Zelle einströmen können. TRPC6 Monomere können dabei mit den abgebildeten TRPC-Monomeren Tetramere bilden (aus 3). Molekulare Aktivierungsmechanismen des TRPC6-Kanals werden u.a. in der Arbeitsgruppe durch Förster-Resonanzenergie-Transfer (FRET) untersucht (4).
Als Mitglied des Deutschen Zentrums für Lungenforschung (DZL) konnten wir vielfältige Rollen von TRP-Kanälen in der Lunge identifizieren. In primären Lungenfibroblasten wird TRPC6 nach Applikation des Cytokins „transforming growth factor beta" (TGF-β) exprimiert und fördert die Myofibroblastendifferenzierung und die Ausbildung einer Lungenfibrose (5). Am sog. Speicher-operierten Ca2+-Einstrom in diese Zellen sind TRPC-Kanäle hingegen nicht beteiligt (6). Außerdem konnten wir die essentielle Rolle des Kanals bei der akuten hypoxischen pulmonalen Vasokonstriktion (aHPV oder dem „Euler-Liljestrand-Reflex“) pulmonaler arterieller glatter Muskelzellen nachweisen ((7) und http://www.uni-marburg.de/aktuelles/news/2007/1008c). So entwickeln TRPC6-defiziente Mäuse eine lebensbedrohliche akute arterielle Hypoxämie als Folge einer partiellen Lungenblockade. Daraus ergibt sich in Zukunft die einzigartige Möglichkeit, durch eine genaue Aufklärung der Signaltransduktionskaskade wichtige pharmakologische Angriffspunkte für TRPC6-Aktivatoren zu identifizieren, die zur therapeutischen Intervention bei Patienten mit Sepsis, Pneumonie und anderen systemischen Entzündungsreaktionen eingesetzt werden können, um eine arterielle Hypoxämie zu verhindern (Abb. 2).
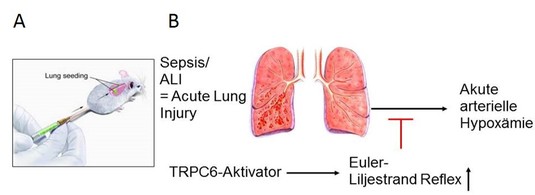
Abb. 2: (A) Injektion von Pharmaka in die lebende Maus und Anreicherung in der Lunge.
(B) Pharmakotherapie mit TRPC6-Aktivatoren zur Steigerung der akuten HPV (Euler-Liljestrand Reflex) bei partieller Lungenblockade und Verhinderung einer akuten arteriellen Hypoxämie.
Neben den glatten Muskelzellen sind die Endothelzellen der Lungenblutgefäße unverzichtbar für den pulmonalen Gasaustausch. Wir konnten zeigen, dass ein Fehlen des TRPC6-Kanals TRPC6-defiziente Mauslungen vor der sog. Ischämie-Reperfusions induzierten Ödembildung schützt. Dieser Schaden kann beim Transport der nicht-durchbluteten (=ischämischen) Lungen und der folgenden Transplantation in einen Patienten auftreten und endet oft tödlich. In den frühen Phasen des Schadens ist eine TRPC6-vermittelte Erhöhung der Endothelzellpermeabilität wichtig, die in den TRPC6-defizienten Endothelzellen vermindert ist (siehe 8). Interessanterweise konnten wir mit einem spezifischen TRPC6-Inhibitor aus dem Labor von Prof. Michael Schäfer, Universität Leipzig, das durch Ischämie und Reperfusion induzierte Ödem in der Mauslunge bereits reduzieren (9).
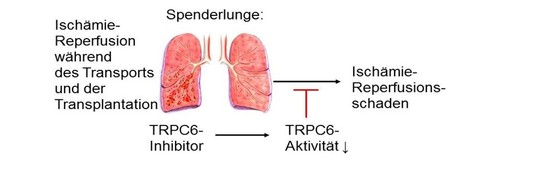
Abb. 3: TRPC6-Inhibitoren, die in-vitro während des Transports zum Empfänger in Spenderlungen appliziert werden könnten, haben das Potential, in Zukunft den Ischämie-Reperfusionsschaden der Lungen zu vermindern.
Ein anderer TRP-Kanal der Vanilloid-Familie (TRPV4) hingegen sorgt in alveolären TypII-Zellen des Lungenepithels für eine Versorgung mit sog. Surfactant (Surfactant Protein C (SP-C)) zum Schutz und zur verbesserten Sauerstoffaufnahme. In Abwesenheit des TRPV4-Kanals kommt es in alternden Mäusen zu einer vermehrten Zerstörung der Struktur der Lungenbläschen (Alveole) durch Emphysem-artige Veränderungen, die auch - im Gegensatz zur TRPC6-defizienten Lunge - zu einer Erhöhung der Ischämie-Reperfusions induzierten Ödembildung führen. Außerdem ist die Ausbildung eines wasserführenden Kanals (Aquaporin 5 (AQP5)), die Barrierefunktion und Migration in alveolären TypI-Zellen reduziert (10).
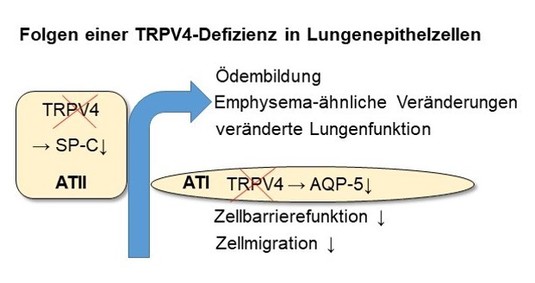
Abb. 4: Ein Fehlen von TRPV4-Kanälen im Lungenepithel reduziert die Versorgung mit Surfactant (Surfactant-Protein C (SP-C) in alveolären TypII (ATII)-Zellen, was zu emphysemartigen Veränderungen und einer gestörten Lungenfunktion vor allem in älteren Mäusen führt. Darüber hinaus wird in alveolären TypI (ATI)-Zellen der wasserführende Kanal Aquaporin 5 (AQP-5) geringer exprimiert, was die Migration und Barrierefunktion dieser Zellen vermindert. Insgesamt zeigen TRPV4-defiziente - im Gegensatz zu TRPC6-defizienten - Lungen ein erhöhte Ischämie-Reperfusion-induzierte Ödembildung (aus 10 und Video).
Andere TRP-Kanäle wie TRPA1 (11), TRPM2 und TRPV4 werden ebenfalls in verschiedenen Geweben der Lunge exprimiert. Deren physiologische Rolle soll im Rahmen des Transregio-Collaborative Research Center 152 aufgeklärt werden. Eine weitere mögliche Funktion für TRP-Kanäle als Sensoren für toxische Substanzen und Bestrahlung in der Lunge (12, 13) wird im neu geschaffenen Graduiertenkolleg untersucht.
Darüber hinaus spielen TRP-Kanäle vielfältige Rollen in den Nieren (2, 14), bei allergischen Reaktionen in den Bronchien (15), im Skelettmuskel (16), für die gastrointestinalen Motilität (17) den Tastsinn (18), sowie bei der neuronalen Transmission (19) und beim Verhalten (20). Außerdem können Aktivitäts-mindernde Mutationen im TRPC6-Kanal Autismus begünstigen (21). Alle diese Themenfelder werden in Zusammenarbeit mit anderen Kooperationspartnern in der ganzen Welt bearbeitet. Wir benutzen molekular- und zellbiologische Methoden sowie intrazelluläre Biosensoren, um die beschriebenen Zelltypen aus verschieden Mausmodellen funktionell zu vergleichen.
Ausgewählte Referenzen:
1. Dietrich, A. (2019) Modulators of Transient Receptor Potential (TRP) Channels as Therapeutic Options in Lung Disease. Pharmaceuticals 12:23. doi: 10.3390/ph12010023.
2. Dietrich, A., Chubanov, V., Gudermann, T. (2010). Renal TRPathies, J of Am Soc Nephrol 21: 736-744.
3. Dietrich, A, Gudermann, T. (2014) TRPC6. Handbook of Experimental Pharmacology 222, Springer Verlag Heidelberg, 157-188.
4. Fiedler, S., Storch, U., Erdogmus, S., Gudermann, T., Mederos Y Schnitzler, M., Dietrich, A. (2019). Small Fluorescein Arsenical Hairpin-Based Förster Resonance Energy Transfer Analysis Reveals Changes in Amino- to Carboxyl-Terminal Interactions upon OAG Activation of Classical Transient Receptor Potential 6. Mol Pharm 96(1):90-98. doi: 10.1124/mol.119.115949.
5. Hofmann, K., Fiedler, S., Vierkotten, S., Weber, J., Klee, S., Jia, J., Zwickenpflug, W., Flockerzi, V., Storch, U., Yildirim, A.Ö., Gudermann, T., Königshoff, M., Dietrich, A. (2017). Classical transient receptor potential (TRPC6) channels support myofibroblast differentiation and development of experimental pulmonary fibrosis. Biochem Biophys Acta 1863: 560-568.
6. Bendiks, L., Geiger, F., Gudermann, T., Feske, S., Dietrich, A. (2020). Store-operated Ca2+ entry in primary murine lung fibroblasts is independent of classical transient receptor potential (TRPC) channels and contributes to cell migration. Sci Rep. 2020 Apr 22;10(1):6812
7. Weissmann*, N., Dietrich*, A., Fuchs, B., Kalwa, H., Ay, M., Dumitrascu, R., Olschewski, A., Mederos y Schnitzler, M., Ghofrani, H.A., Schermuly, R.T., Pinkenburg, O., Seeger, W., Grimminger, F. and Gudermann, T. (2006). Classical transient receptor potential channel 6 (TRPC6) is essential for hypoxic pulmonary vasoconstriction and alveolar gas exchange. Proc. Natl. Acad. Sci. U.S.A. 103, 19093-19098. *equal contributing and corresponding authors.
8. Weissmann, N., Sydykov, A., Kalwa, H., Storch, U., Fuchs, B., Mederos y Schnitzler, M., Brandes, R.P., Grimminger, F., Meissner, M., Freichel, M., Offermanns, S., Veit, F., Pak, O., Krause, K.-H., Schermuly, R.T., Brewer, A.C., Schmidt, H.H.H.W., Seeger, W., Shah, A.M., Gudermann, T., Ghofrani, H.A. & Dietrich, A. (2012). Activation of TRPC6 channels is essential for ischemia–reperfusion-induced lung edema in mice. Nature Commun 3: 649.
http://www.nature.com/ncomms/journal/v3/n1/full/ncomms1660.html
9. Häfner, S., Burg, F., Kannler, M., Urban, N., Mayer, P., Dietrich, A., Trauner, D., Broichhagen, J., Schaefer. M. (2018). A (+)-Larixol Congener with High Affinity and Subtype Selectivity toward TRPC6. ChemMedChem 13:1028-1035. doi: 10.1002/cmdc.201800021.
10. Weber, J., Rajan, S., Schremmer, C., Chao, Y.K., Krasteva-Christ, G., Kannler, M., Yildirim, A.Ö., Brosien, M., Schredelseker, J., Weissmann, N., Grimm, C., Gudermann, T., Dietrich, A. (2020). TRPV4 channels are essential for alveolar epithelial barrier function as protection from lung edema. JCI Insight 5:e134464. doi: 10.1172/jci.insight.134464.
11. Kannler, M., Lüling, R., Yildirim, A.Ö., Gudermann, T., Steinritz, D., Dietrich, A. (2018). TRPA1 channels: expression in non-neuronal murine lung tissues and dispensability for hyperoxia-induced alveolar epithelial hyperplasia. Pflügers Arch. 470: 1231-1241.
12. Dietrich, A., Steinritz, D., Gudermann, T. (2017). Transient receptor potential (TRP) channels as molecular targets in lung toxicology and associated diseases. Cell Calcium 67:123-137. doi: 10.1016/j.ceca.2017.04.005.
13. Käsmann, L., Dietrich, A., Staab-Weijnitz, C.A., Manapov, F., Behr, J., Rimner, A., Jeremic, B., Senan, S,, De Ruysscher, D., Lauber, K., Belka. C. (2020). Radiation-induced lung toxicity - cellular and molecular mechanisms of pathogenesis, management, and literature review. Radiat Oncol 15: 214. doi: 10.1186/s13014-020-01654-9.
14. Kalwa, M., Storch, U., Demleitner, J., Fiedler, S., Mayer, T., Kannler, M., Fahlbusch, M., Barth, H., Smrcka, A., Hildebrandt, F., Gudermann, T. and Dietrich, A., (2015). Phospholipase C epsilon-induced TRPC6 activation: A common but redundant mechanism in primary podocytes. J Cell Physiol 230:1389-1399.
15. Sel, S., Rost, B., Yildirim, A.Ö., Sel, B., Kalwa, H., Fehrenbach, H., Renz, H., Gudermann, T., Dietrich, A. (2008). Loss of classical transient receptor potential 6 reduces allergic airway response. Clin Exp Allergy 38, 1548-1558.
16. Zanou, N., Shapovalov, G., Louis, M., Tajeddine,N., Gallo, C., Van Schoor, M., Anguish, I., Cao, M.L., Schakman, O., Dietrich, A., Lebacq, J., Ruegg, U., Roulet, E., Birnbaumer, L., Gailly, P. (2010). Role of TRPC1 channels in skeletal muscle function. Am J of Physiol, Cell Physiology 298: C149-C162
17. Tsvilovskyy, V.V., Zholos, A.V., Aberle, T., Dietrich, A., Zhu, M.X., Birnbaumer, L., Freichel, M., Flockerzi, V. (2009). Deletion of TRPC4 and TRPC6 in mice impairs smooth muscle contraction and intestinal motility in vivo. Gastroenterology, 137: 1415-1424.
18. Garrison, S.R., Dietrich, A., Stucky, C.L. (2012). TRPC1 contributes to light-touch sensation and mechanical responses in low-threshold cutaneous sensory neurons. J Neurophysiol 107: 913-922.
19. Hartmann, J., Dragicevic, E., Adelsberger, H., Henning, H., Sumser, M., Abramowitz, J., Blum, R., Dietrich, A., Freichel, M., Flockerzi, V., Birnbaumer, L., Konnerth, A. (2008). TRPC3 channels are required for synaptic transmission and motor coordination. Neuron 59, 392-398.
20. Beis, D., Schwarting, R.K., Dietrich, A. (2011). Evidence for a supportive role of classical transient receptor potential 6 (TRPC6) in the exploration behaviour of mice. Physiol Behav, 102: 245-250.
21. Griesi-Oliveira, K., Acab, A., Gupta, A.R., Sunaga, DY., Chailangkarn, T., Nicol, X., Nunez, Y., Walker, M.F., Murdoch, J.D., Sanders, S.J., Fernandez, T.V., Ji, W., Lifton, R.P., Vadasz, E., Dietrich, A., Pradhan, D., Song, H., Ming, G-l, Guoe, X., Haddad, G., Marchetto, M.C.N., Spitzer, N., Passos-Bueno, M.R., State, M.W., Muotri, A.R. (2015). Modeling non-syndromic autism and the impact of TRPC6 disruption in human neurons. Mol Psychiatry 20: 1350- 1365.
Alle Literaturangaben zu finden bei PubMed.

Abb. 5: Die Arbeitsgruppe Dietrich im Jahr 2020 von links nach rechts: Bettina Braun, Alexander Dietrich, Fabienne Geiger, Suhasini Rajan, Christian Schremmer und Philipp Alt.

