AG Gudermann/Chubanov "Melastatin-related TRP Channels"
Ca2+-permeable Kationenkanäle
Leitung: Dr. Vladimir Chubanov
Technische Assistentin:
Joanna Zaißerer
Doktorandinnen/Ph/D students
Miyuki Egawa: Cellular functions of TRPM channels
Medizindoktoranen/Medizindoktorandinnen/M.D. students:
Anna Rössig (FoeFoLe fellow): TRPM channels as new drug targets
Studentische Hilfskräfte und wissenschaftliche Assistentin
Anna Erbacher
Lisa Pleninger
Abgeschlossene Arbeiten:
Moritz Meißner (M.D.)
Annika Wisnowsky (Dr. rer. nat.)
Silvia Ferioli (Dr. rer. nat.)
Sebastian Schäfer (M.D., FoeFoLe fellow)
Benjamin Stadlbauer (M.D., FoeFoLe fellow),
Lorenz Mittermeier (Dr. rer. nat.)
Banu Akdogan (PhD): TRPM channels in respiratory system
Eva Schmidt (Dr. rer. nat.): Biophysical assessment of TRPM channels
Melastatin-related TRP Channels
Die Forschungsgruppe konzentriert sich auf eine neu entdeckte Gruppe von Plasmamembran-Proteinen, die als TRPM6 und TRPM7 bezeichnet werden. Diese bemerkenswerten Proteine umfassen zwei unterschiedliche Domänen: ein Ionenkanal-Segment und eine Proteinkinase-Domäne. Die Kanalsegmente von TRPM6 und TRPM7 weisen eine große Homologie mit den Melastatin-verwandten TRP (TRPM) Kanälen auf, während die Kinase-Domänen dem α-Typ der Serin-/Threoninprotein-Kinasen ähneln.
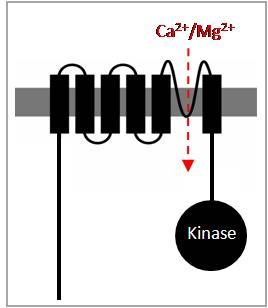
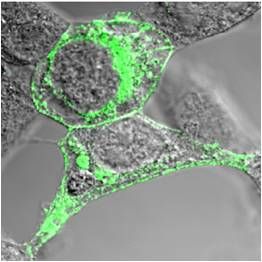
| Abb. 1: TRPM6- und TRPM7-Kanäle besitzen eine Kinasedomäne | Abb. 2: Darstellung von rekombinantem TRPM7 auf der Zelloberfläche mittels Immunofluoreszenz |
Erste Erkenntnisse über die Funktion der TRPM-Gene liegen erst seit wenigen Jahren vor, doch haben diese Untersuchungen bereits zu einigen bemerkenswerten Entdeckungen geführt. Zum Beispiel wurde der TRPM8-Kanal als zellulärer Sensor für das Kälteempfinden und als Rezeptor für Menthol lokalisiert. Menthol ist aus der traditionellen Medizin und als Geschmacksstoff für Nahrungsmittel bekannt. Vor Kurzem wurde herausgefunden, dass der TRPM5-Kanal von Bedeutung für die chemosensorische Funktion von Geschmacksrezeptorzellen, sowie jüngst entdeckten sensorischen Zellen in der Lunge und im Magen-Darm-Trakt ist.
Die durch TRPM6/M7 geformten Kanalporen ermöglichen den Einstrom von Ca2+/Mg2+- und anderen zweiwertigen Kationen in die Zelle. TRPM6/M7 ähnliche Ströme wurden in allen bislang untersuchten Säugetierzellen gefunden, ein klarer Hinweis auf die immanente Rolle dieses Kanaltyps in der Zelle. Es wird angenommen, dass der TRPM6/M7-bedingte Kationeneinstrom auf die Mg2+-Homöostase, Zellteilung, Proliferation, Mechanosensitivität, Exocytose und andere zelluläre Prozesse regulierend wirkt.
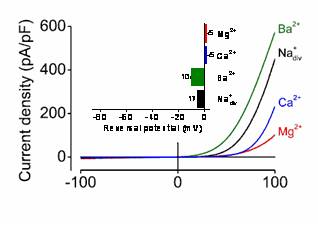
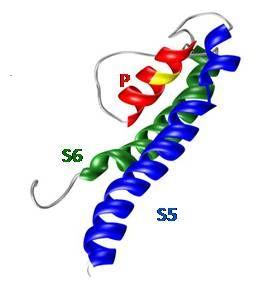
| Abb. 3: Patch-clamp Messung von TRPM7-Strömen in der Ganzzellkonfiguration | Abb. 4: 3D-Modell der Porenregion von TRPM6 |
Die physiologische Rolle von α-Kinasen ist noch weniger erforscht. Die am besten erforschte α-Kinase ist die Elongation-Factor-2-Kinase, die die Geschwindigkeit der Proteinsynthese in Reaktion auf Nährstoffmangel und ER-Stress reguliert. Vor Kurzem wurden Annexin A1 und einige Myosin-II-Isoformen als mutmaßliche physiologische Substrate der TRPM6/M7-Kinasen identifiziert.
Zusammenfassend zeigten erste Studien, dass TRPM6 und TRPM7 multifunktionelle Proteine sind, die wichtig für zahlreiche Prozesse in Zellen erforderlich sind. Im Vergleich mit anderen TRP-Kanälen wissen wir jedoch noch sehr wenig über diese wichtigen Proteine. Meine Arbeitsgruppe befasst sich daher mit den folgenden Forschungsprojekten:
Aktuelle Projekte
- Wir untersuchen die Beteiligung verschiedener Domänen auf die funktionellen Eigenschaften von TRPM6/M7. Zu diesem Zweck setzen wir ein breites Spektrum molekularbiologischer, biochemischer und biophysikalischer Methoden ein. Wir nutzen z. B. die zielgerichtete Mutagenese, um für die Funktion wichtige Aminosäurereste von TRPM6 und TRPM7 zu verändern und anschließend die Auswirkung dieser Veränderungen auf funktionelle Eigenschaften der Kanäle mittels Patch-Clamp-Techniken und Single-Cell Ca2+-Imaging auszuwerten. Für die Beobachtung von Aufbau und „trafficking“ der TRPM6/M7-Kanalkomplexe nutzen wir das Fluoreszenz-Resonanz-Energie-Transfer-Verfahren (FRET) und das konfokale Laser-Scanning-Mikroskop. Durch diese Studien werden wir besser verstehen, welche funktionellen Eigenschaften der, mit der Kinase verbundenen, Kanäle entscheidend für ihre zelluläre Wirkung sind.
- Das Expressionsprofil eines nativen Gens gibt unverfälschte und unerlässliche Informationen über seine physiologische Rolle. Zu diesem Zweck haben wir eine Reihe von TRPM6- und TRPM7-spezifischen Antikörpern generiert. Aktuell verwenden wir diese Antikörper, um native Proteine in Mausegeweben zu erkennen und um sie in einigen Fällen in bestimmten subzellulären Bereichen zu lokalisieren.
- Bislang stehen noch keine pharmakologischen Wirkstoffe zur Verfügung, die als spezifische Aktivatoren oder Blocker der Kanäle TRPM6 und M7 fungieren. Daher führen wir ein High-Throughput-Screening (HTS) durch, um chemische Substanzen mit der Zielstruktur TRPM6 und M7 zu identifizieren.
- Wir arbeiten mit TRPM6-defizienten Mäusen, um die Rolle von TRPM6 in vivo zu erforschen. Diese Untersuchungen schließen eine umfassende Phänotypisierung von TRPM6-/--Mäusen sowie die molekulare Analyse der aus ihnen gewonnenen Zellen ein.

